ГОСТ EN 14122-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКТЫ ПИЩЕВЫЕ
Определение витамина B с помощью высокоэффективной жидкостной хроматографии
Foodstuffs. Determination of vitamin B by HPLC
МКС 67.050
Дата введения 2015-07-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Государственным научным учреждением Всероссийским научно-исследовательским институтом консервной и овощесушильной промышленности Российской академии сельскохозяйственных наук (ГНУ ВНИИКОП Россельхозакадемии)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии (ТК 093)
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 5 ноября 2013 г. N 61-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 04 марта 2014 г. N 77-ст межгосударственный стандарт ГОСТ EN 14122-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2015 г.
5 Настоящий стандарт идентичен европейскому региональному стандарту EN 14122:2003* Foodstuffs. Determination of vitamin B by HPLC (Продукты пищевые. Определение витамина В
с помощью высокоэффективной жидкостной хроматографии).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Европейский региональный стандарт разработан техническим комитетом CEN/TC 275 "Анализ пищевых продуктов. Горизонтальные методы", секретариатом которого считается DIN.
Перевод с немецкого языка (ge).
Официальные экземпляры международного стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, имеются в Федеральном агентстве по техническому регулированию и метрологии Российской Федерации.
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам приведены в дополнительном приложении ДА.
Степень соответствия - идентичная (IDT)
6 ВЗАМЕН ГОСТ 25999-83 в части разделов 3 и 4
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
ПРЕДУПРЕЖДЕНИЕ - Применение настоящего стандарта предусматривает использование опасных веществ, процедур и оборудования. В задачи настоящего стандарта не входит решение всех проблем, связанных с безопасностью его применения. Ответственность за принятие мер предосторожности и соблюдение правил техники безопасности лежит на пользователе стандарта.
1 Область применения
Настоящий стандарт устанавливает метод определения витамина B в пищевых продуктах с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Содержание витамина B
определяется как общее содержание тиамина, включая его фосфорилированные производные.
2 Нормативные ссылки
Настоящий стандарт содержит отдельные положения из другого нормативного документа*, обозначенного приведенной в данном разделе датированной нормативной ссылкой. Все последующие изменения ссылочного нормативного документа допустимо использовать только после внесения соответствующих изменений в настоящий стандарт.
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
EN ISO 3696:1995 Water for analytical laboratory use - Specification and test methods (ISO 3696:1987) (Вода для лабораторного анализа. Технические требования и методы испытаний)
3 Сущность метода
Метод основан на экстракции тиамина из пробы путем кислотного гидролиза, последующем ферментативном дефосфорилировании тиамина и его количественном определении с помощью ВЭЖХ с применением предварительной, либо послеколоночной конверсии в тиохром [1]-[6].
4 Реактивы
4.1 Общие положения
Для проведения анализа при отсутствии особо оговоренных условий используют только реактивы гарантированной аналитической чистоты и воду не ниже первой степени чистоты по EN ISO 3696 или бидистиллированную воду.
4.2 Реактивы и растворы
4.2.1 Метанол для ВЭЖХ чистотой не менее 99,8%.
4.2.2 Кислота уксусная, раствор молярной концентрации ![]() 0,02 моль/дм
0,02 моль/дм.
4.2.3 Спирт изобутиловый (изобутанол) чистотой не менее 98%.
4.2.4 Натрий фосфорнокислый однозамещенный чистотой не менее 99,8%.
4.2.5 Кислота соляная массовой долей 36%.
4.2.6 Кислота соляная, раствор молярной концентрации ![]() 0,1 моль/дм
0,1 моль/дм.
4.2.7 Кислота серная, раствор молярной концентрации ![]() 0,05 моль/дм
0,05 моль/дм.
4.2.8 Натрия гидроокись чистотой не менее 99%.
4.2.9 Натрия гидроокись, раствор массовой концентрации ![]() 150 г/дм
150 г/дм.
4.2.10 Натрия гидроокись, раствор массовой концентрации ![]() 200 г/дм
200 г/дм.
4.2.11 Калия гексацианоферрат (III) чистотой не менее 99%.
4.2.12 Калия гексацианоферрат (III), раствор массовой концентрации ![]() 10 г/дм
10 г/дм.
4.2.13 Калия гексацианоферрат (III), щелочной раствор массовой концентрации ![]() 0,4 г/дм
0,4 г/дм для предколоночной дериватизации
Раствор гексацианоферрата (III) калия (см. 4.2.12) объемом 2 см разбавляют раствором гидроокиси натрия (см. 4.2.9) до объема 50 см
.
Раствор готовят в день проведения испытания.
4.2.14 Калия гексацианоферрат (III), щелочной раствор массовой концентрации ![]() 0,5 г/дм
0,5 г/дм для послеколоночной дериватизации
Раствор гексацианоферрата (III) калия (см. 4.2.12) объемом 2,5 см разбавляют раствором гидроокиси натрия (см. 4.2.10) до объема 50 см
.
4.2.15 Дефосфорилирующий фермент, пригодный для гидролиза связанного тиамина в пробе.
Примечание - При установлении характеристик прецизионности методики использована така-диастаза*.
________________
* Така-диастаза N Т00040 - торговое наименование изделия, выпускаемого Platz and Bauer, Waterbury, СТ 06708, США. Данная информация приведена для удобства пользования настоящего стандарта и не является рекламной поддержкой МГС данного изделия. Допускается использовать аналогичные изделия при условии обеспечения идентичных результатов.
4.2.16 Натрий уксуснокислый, раствор молярной концентрации ![]() 2,5 моль/дм
2,5 моль/дм.
4.2.17 Натрий уксуснокислый, раствор молярной концентрации ![]() 0,5 моль/дм
0,5 моль/дм.
4.2.18 Подвижные фазы для ВЭЖХ
Варианты подвижных фаз подходящего состава приведены в приложении A. В частности, в качестве подвижных фаз используют смеси метанола с водой, фосфатным или ацетатным буферным раствором при объемной доле метанола от 10% до 50%, а также подвижные фазы с добавлением ион-парных реагентов.
4.2.19 Раствор буферный фосфатный (3,5) молярной концентрации однозамещенного фосфата калия
![]() 9,0 ммоль/дм
9,0 ммоль/дм.
4.2.20 Тетраэтиламмония хлорид чистотой не менее 98%.
4.2.21 Натрия гептансульфонат чистотой не менее 98%.
4.2.22 Раствор буферный ацетатный (4) молярной концентрации уксусной кислоты
![]() 50 ммоль/дм
50 ммоль/дм.
4.3 Образцы сравнения
4.3.1 Общие положения
Гидрохлорид тиаминхлорида выпускается многими производителями, при этом его чистота может различаться. Это обусловливает необходимость определения концентрации градуировочного раствора тиамина спектрофотометрическим методом по 4.4.4.
4.3.2 Тиаминхлорида гидрохлорид (![]() ) чистотой не менее 99%.
) чистотой не менее 99%.
4.3.3 Тиаминмонофосфатхлорид (![]() ) чистотой не менее 98%.
) чистотой не менее 98%.
4.3.4 Тиаминпирофосфатхлорид (кокарбоксилаза) (![]() ) чистотой не менее 98%.
) чистотой не менее 98%.
4.4 Основные стандартные растворы
4.4.1 Тиаминхлорида гидрохлорид, раствор массовой концентрации ![]() 0,1 мг/см
0,1 мг/см
Образец сравнения гидрохлорида тиаминхлорида (см. 4.3.2) массой, например, около 10 мг, измеренной с высокой точностью, растворяют в заданном объеме, например, 100 см подходящего растворителя, например, раствора соляной кислоты (см. 4.2.6).
Срок хранения раствора при температуре 4°C - четыре недели.
4.4.2 Тиаминмонофосфата хлорид, раствор массовой концентрации ![]() 0,1 мг/см
0,1 мг/см
Около 10 мг образца сравнения тиаминмонофосфатхлорида (см. 4.3.3), измеренной с высокой точностью, растворяют в 100 см подходящего растворителя, например, раствора соляной кислоты (см. 4.2.6).
Срок хранения раствора при температуре минус 20°C - четыре недели.
4.4.3 Тиаминпирофосфата хлорид, раствор массовой концентрации ![]() 0,1 мг/см
0,1 мг/см
Около 10 мг образца сравнения тиаминпирофосфатхлорида (см. 4.3.4), измеренной с высокой точностью, растворяют в 100 см подходящего растворителя, например, раствора соляной кислоты (см. 4.2.6).
4.4.4 Определение точной концентрации основного раствора гидрохлорида тиаминхлорида
В мерную колбу вместимостью 100 см помещают 10 см
основного раствора гидрохлорида тиаминхлорида (см. 4.4.1), объем содержимого в колбе доводят до метки раствором соляной кислоты (см. 4.2.6). Измеряют оптическую плотность полученного раствора на спектрофотометре (см. 5.2) в кварцевой кювете длиной оптического пути 1 см при длине волны 247 нм, соответствующей максимуму поглощения. В качестве раствора сравнения используют раствор соляной кислоты (см. 4.2.6). Массовую концентрацию гидрохлорида тиаминхлорида в основном стандартном растворе
, мкг/см
, рассчитывают по формуле
![]() , (1)
, (1)
где - значение оптической плотности при длине волны 247 нм, соответствующей максимуму поглощения;
10 - коэффициент пересчета концентрации измеряемого раствора в микрограммы на кубический сантиметр;
10 - коэффициент, учитывающий кратность разбавления основного стандартного раствора;
421 - коэффициент экстинкции раствора гидрохлорида тиаминхлорида в растворе соляной кислоты молярной концентрации 0,1 моль/дм
[7], соответствующий условной оптической плотности раствора гидрохлорида тиаминхлорида массовой концентрации 10 г/дм
.
4.5 Градуировочные растворы
4.5.1 Градуировочные растворы гидрохлорида тиаминхлорида массовой концентрации от 1 до 10 мкг/см
Пипеткой отмеряют от 1 до 10 см основного стандартного раствора тиаминхлорида гидрохлорида (см. 4.4.1) и помещают в мерную колбу вместимостью 100 см
. Объем содержимого в колбе доводят до метки раствором соляной кислоты (см. 4.2.6).
Срок хранения полученного раствора в темном месте при температуре 4°C - 1 мес.
4.5.2 Градуировочные растворы хлорида тиаминмонофосфата массовой концентрации от 1 до 10 мкг/см
Пипеткой отмеряют от 1 до 10 см основного стандартного раствора хлорида тиаминмонофосфата (см. 4.4.2) и помещают в мерную колбу вместимостью 100 см
. Объем содержимого в колбе доводят до метки раствором соляной кислоты (см. 4.2.6).
Срок хранения полученного раствора в темном месте при температуре 4°C - 1 мес.
4.5.2* Градуировочные растворы хлорида тиаминпирофосфата массовой концентрации от 1 до 10 мкг/см
_________________
* Нумерация соответствует оригиналу. - .
Пипеткой отмеряют от 1 до 10 см основного стандартного раствора хлорида тиаминпирофосфата (см. 4.4.3) и помещают в мерную колбу вместимостью 100 см
. Объем содержимого в колбе доводят до метки раствором соляной кислоты (см. 4.2.6).
Срок хранения полученного раствора в темном месте при температуре 4°C - 1 мес.
5 Аппаратура
5.1 Общие положения
При проведении анализа используют лабораторные приборы, оборудование и стеклянную посуду, в частности, перечисленные ниже.
5.2 Спектрофотометр, пригодный для измерений оптической плотности в ультрафиолетовой области спектра при заданной длине волны.
5.3 Автоклав или нагревательный прибор
Автоклав с контролем температуры и давления или плитка электрическая, или баня водяная с контролем температуры.
5.4 Хроматограф жидкостный
Система для ВЭЖХ, состоящая из насоса, инжектора, флюориметрического детектора, позволяющего проводить измерения при длинах волн возбуждения и эмиссии, указанных в приложении А, например, 366 нм и 420 нм соответственно, и устройства регистрации и обработки аналитического сигнала, например, интегратора.
5.5 Колонка аналитическая для ВЭЖХ
5.5.1 Общие положения
Допускается использовать колонку другого внутреннего диаметра и длины, и заполненную сорбентом другого размера частиц, чем те, что указаны в настоящем стандарте. Условия хроматографического разделения подбирают применительно к используемой колонке для обеспечения сопоставимости результатов анализов. Критерием пригодности аналитической колонки является отделение пика аналита от пиков других компонентов матрицы пробы на уровне базовой линии.
5.5.2 Колонка для ВЭЖХ при анализе с использованием предколоночного окисления тиамина
Колонка длиной от 100 до 250 мм, внутренним диаметром от 4,0 до 4,6 мм, заполненная сорбентом* размером частиц 5 мкм.
_______________
* Пригодность для проведения анализа установлена в отношении следующих марок сорбентов на основе силикагеля, доступных для приобретения: Lichrosorb Si-60, Spherosorb
Si, Hypersil
Si и Lichrospher
100 Diol. Пригодность для проведения анализа установлена в отношении следующих марок обращенно-фазовых сорбентов: Liuchrospher Si 60 RP Select, Spherisorb
ODS,
-Bondapak
radial C18, Supelco
LC-18-DB и Hypersil
ODS. Данная информация приведена исключительно для удобства применения настоящего стандарта, не является рекламной поддержкой МГС данных изделий и не исключает возможность использования других изделий с аналогичными свойствами.
5.5.3 Колонка для ВЭЖХ при анализе с использованием послеколоночного окисления тиамина
Колонка длиной от 100 до 250 мм, внутренним диаметром от 4,0 до 4,6 мм, заполненная сорбентом* размером частиц 5 мкм.
_______________
* Пригодность для проведения анализа установлена в отношении следующих марок сорбентов на основе силикагеля, доступных для приобретения: Lichrosorb Si-60, Spherosorb
Si, Hypersil
Si и Lichrospher
100 Diol. Пригодность для проведения анализа установлена в отношении следующих марок обращенно-фазовых сорбентов: Liuchrospher Si 60 RP Select, Spherisorb
ODS,
-Bondapak
radial C18, Supelco
LC-18-DB и Hypersil
ODS. Данная информация приведена исключительно для удобства применения настоящего стандарта, не является рекламной поддержкой МГС данных изделий и не исключает возможность использования других изделий с аналогичными свойствами.
5.6 Установка для фильтрации
Фильтрование подвижной фазы перед ее использованием и раствора пробы для хроматографического анализа перед инжекцией через мембранный фильтр размером пор, например, 0,45 мкм, продлевает срок службы аналитических колонок.
5.7 Система для послеколоночной дериватизации
Система, состоящая из насоса для подачи реактива для дериватизации, соединительного элемента для трех капилляров и реактора в виде капилляра длиной 10 м и внутренним диаметром 0,33 мм.
6 Проведение анализа
6.1 Подготовка пробы
Пробу гомогенизируют, продукты твердой консистенции измельчают с помощью подходящей мельницы, после чего перемешивают. Перед измельчением пробу рекомендуется предварительно охладить, чтобы не подвергать ее длительному воздействию высоких температур.
6.2 Приготовление раствора пробы для анализа
6.2.1 Экстракция
От 2 до 10 г анализируемой пробы, измеренной с точностью до 0,001 г, помещают в коническую колбу. Добавляют раствор соляной кислоты (см. 4.2.6) или серной кислоты (см. 4.2.7) объемом от 60 до 200 см. Значение
полученной смеси должно быть не более 3,0. Колбу закрывают часовым стеклом и выдерживают в автоклаве при температуре 121°C в течение 30 мин, либо на водяной бане при температуре 100°C в течение 60 мин.
Примечание - Согласно результатам исследований, кислотный гидролиз допустимо проводить при различных условиях, в частности, при температуре от 95°C до 130°C и продолжительности гидролиза от 15 до 60 мин. При этом, чем выше температура, тем меньше времени требуется для проведения гидролиза.
6.2.2 Ферментативная обработка
После охлаждения до комнатной температуры к экстракту добавляют раствор ацетата натрия (см. 4.2.16 или 4.2.17) до достижения значения , оптимального для действия предполагаемого к использованию фермента. В экстракт вносят необходимое количество дефосфорилирующего фермента (см. 4.2.15). Полученную смесь выдерживают в течение промежутка времени и при температуре, оптимальных для используемого фермента. После охлаждения до комнатной температуры полученный раствор переносят в защищенную от света мерную колбу с помощью дистиллированной воды или другого подходящего растворителя и доводят объем содержимого в колбе до метки (
).
Для каждого ферментного препарата устанавливают оптимальное значение и оптимальные температуру и продолжительность инкубации.
Для установления оптимальных условий дефосфорилирования проводят процедуру ферментативной обработки проб с добавлением хлорида тиаминмонофосфата (см. 4.3.3) или хлорида тиаминпирофосфата (см. 4.3.4), а также проб, аналогичных исследуемой пробе по составу матрицы и являющихся аттестованными образцами сравнения.
При использовании для дефосфорилирования така-диастазы возможно привнесение в пробу с ферментным препаратом некоторого количества тиамина, что необходимо учитывать при расчете результата испытания.
Примечания
1 При установлении характеристик прецизионности, приведенных в настоящем стандарте, для проведения дефосфорилирования использована така-диастаза при следующих условиях. Значение экстракта доводилось до 4,0 добавлением раствора ацетата натрия (см. 4.2.16 или 4.2.17), после чего в экстракт вносили така-диастазу из расчета 100 мг препарата на грамм пробы. Полученную смесь инкубировали при температуре от 37°C до 46°C, продолжительность инкубирования составляла от 16 до 24 ч.
2 Скорость дефосфорилирования зависит от используемого ферментного препарата и матрицы пробы. По имеющимся данным полное дефосфорилирование может быть достигнуто за более короткое время [8].
6.2.3 Окисление тиамина с образованием тиохрома
6.2.3.1 Предколоночное окисление тиамина
В стеклянный флакон или колбу подходящей вместимости помещают 1 см раствора пробы после ферментативной обработки по 6.2.2, либо градуировочного раствора (см. 4.5.1), либо холостого раствора. Добавляют 1 см
щелочного раствора гексацианоферрата (III) калия (см. 4.2.13), содержимое флакона встряхивают в течение 10 с, после чего оставляют в покое на 1 мин. Подготовленный таким образом к хроматографическому анализу раствор пробы, градуировочный раствор или холостой раствор анализируют с помощью обращенно-фазовой ВЭЖХ при условиях, указанных в таблице A.1 приложения A.
В качестве альтернативы после окисления тиамина проводят экстракцию тиохрома из раствора порцией изобутанола (см. 4.2.3) объемом 1,5 см, экстракт анализируют с помощью ВЭЖХ.
С целью удаления из раствора пробы веществ, мешающих анализу, и предотвращения порчи аналитической колонки перед проведением анализа с помощью ВЭЖХ рекомендуется нейтрализовать раствор пробы для анализа добавлением фосфорной кислоты или провести его очистку с помощью твердофазной экстракции по [5].
Примечание - Некоторые компоненты пищевых продуктов, например, полифенольные вещества, могут препятствовать окислению тиамина с образованием тиохрома. Это явление характерно для продуктов, содержащих какао, а также для некоторых других продуктов. Если такая проблема предположительно имеет место, рекомендуется проверить полноту обнаружения аналита путем внесения в экстракт градуировочного раствора тиамина перед проведением процедуры окисления. При низкой полноте обнаружения рекомендуется проводить очистку экстракта с помощью катионообменной смолы или выполнять ВЭЖХ-анализ с применением послеколоночного окисления тиамина.
6.2.3.2 Идентификация аналита при анализе с применением предколоночного окисления тиамина
Проводят хроматографический анализ градуировочных растворов и раствора пробы, подготовленных по 6.2.3.1, при одинаковых объемах инжекции. Пик тиохрома на хроматограмме раствора пробы идентифицируют по совпадению его времени удерживания со временем удерживания пика тиохрома на хроматограмме градуировочного раствора. В качестве альтернативы пик тиохрома на хроматограмме раствора пробы идентифицируют путем ее сопоставления с хроматограммой раствора пробы с добавлением аналитического стандарта.
Ниже приведены условия хроматографического анализа, гарантированно обеспечивающие удовлетворительное качество хроматографического разделения и количественного определения (см. рисунок B.1 приложения B). Альтернативные условия приведены в приложении A.
Аналитическая колонка длиной 250 мм, внутренним диаметром 4 мм, заполненная сорбентом* диаметром частиц 5 мкм.
_______________
* Например, Lichrospher RP Select В, пригодный для целей применения настоящего стандарта. Данная информация приведена для удобства применения настоящего стандарта, не является рекламной поддержкой МГС данного изделия и не исключает возможность использования других изделий с аналогичными свойствами.
Состав подвижной фазы: смесь метанола (см. 4.2.1) с ацетатным буферным раствором (см. 4.2.22).
Скорость протока подвижной фазы - 0,7 см/мин.
Объем инжекции - 20 мм.
Условия флюориметрического детектирования: длина волны возбуждения 366 нм, длина волны эмиссии 435 нм.
6.2.3.3 Послеколоночное окисление тиамина
При послеколоночном окислении тиамина с образованием тиохрома в качестве дериватизирующего реагента используют раствор гексацианоферрата (III) калия (см. 4.2.14), который добавляют в элюат посредством соединительного элемента для трех капилляров при скорости подачи около 0,3 см/мин.
Примечание - Одним из факторов, влияющих на послеколоночную реакцию, является концентрация гидроксида натрия в реакционной смеси. Чрезмерно высокую или чрезмерно низкую концентрацию гидроксида натрия в дериватизирующем реагенте компенсируют соответственно уменьшением или увеличением скорости его подачи.
6.2.3.4 Идентификация аналита при анализе с применением послеколоночного окисления тиамина
Проводят хроматографический анализ градуировочных растворов (см. 4.5.1) и раствора пробы (см. 6.2.2) при одинаковых объемах инжекции. Пик тиохрома на хроматограмме раствора пробы идентифицируют по совпадению его времени удерживания со временем удерживания пика тиохрома на хроматограмме градуировочного раствора. В качестве альтернативы пик тиохрома на хроматограмме раствора пробы идентифицируют путем ее сопоставления с хроматограммой раствора пробы с добавлением аналитического стандарта.
Ниже приведены условия хроматографического анализа, гарантированно обеспечивающие удовлетворительное качество хроматографического разделения и количественного определения. Альтернативные условия приведены на рисунке B.2 и в приложении A.
Аналитическая колонка длиной 250 мм, внутренним диаметром 4,6 мм, заполненная сорбентом* диаметром частиц 5 мкм.
________________
* Например, Supelco LC-18-DB, пригодный для целей применения настоящего стандарта. Данная информация приведена для удобства применения настоящего стандарта, не является рекламной поддержкой МГС данного изделия и не исключает возможность использования других изделий с аналогичными свойствами.
Состав подвижной фазы: смесь метанола (см. 4.2.1) с фосфатным буферным раствором (см. 4.2.19), содержащим 1 г/дм хлорида тетраэтиламммония (см. 4.2.20) и 5 ммоль/дм
гептансульфоната натрия (см. 4.2.21) в объемном соотношении 35:65.
Скорость протока подвижной фазы - 1 см/мин.
Объем инжекции - 20 мм.
Реагент для послеколоночной дериватизации - щелочной раствор гексацианоферрата (III) калия (см. 4.2.14).
Скорость подачи дериватизирующего реагента - 0,3 см/мин.
Условия флюориметрического детектирования: длина волны возбуждения 368 нм, длина волны эмиссии 440 нм.
Примечание - При анализе проб некоторых видов продуктов, например, сырой свинины, на хроматограмме может присутствовать дополнительный пик 1-окситиамина или 2(1-оксиэтил)тиамина [9], [10].
6.3 Количественное определение
Количественное определение проводят по методу внешнего стандарта. При этом либо градуировку осуществляют по градуировочному раствору, на хроматограмме которого площадь или высота пика аналита наиболее близки к таковым на хроматограмме раствора пробы, либо используют градуировочный график. В последнем случае проверяют линейность градуировочной зависимости.
7 Обработка результатов
Результат определения рассчитывают с использованием градуировочного графика, либо с применением соответствующей программы расчета системы обработки данных, либо используют приведенный ниже упрощенный способ расчета.
Содержание витамина B в пробе в расчете на гидрохлорид тиаминхлорида
, мг/100 г, рассчитывают по формуле
![]() , (2)
, (2)
где - площадь или высота пика тиохрома на хроматограмме раствора пробы, выраженная в единицах площади или высоты;
- площадь или высота пика тиохрома на хроматограмме градуировочного раствора, выраженная в единицах площади или высоты;
- объем приготовленного экстракта из пробы по 6.2.2, см
;
- массовая концентрация гидрохлорида тиаминхлорида в градуировочном растворе (см. 4.5.1), мкг/см
;
- масса пробы для анализа, г;
100 - коэффициент пересчета результата как содержания аналита в 100 г пробы;
1000 - коэффициент пересчета результата из мкг/100 г в мг/100 г;
При необходимости представления результата определения в виде содержания в пробе витамина B в расчете на тиаминхлорид (
![]() ) значение, полученное по формуле (2), умножают на коэффициент 0,892.
) значение, полученное по формуле (2), умножают на коэффициент 0,892.
8 Прецизионность
8.1 Общие положения
Значения характеристик прецизионности установлены в 1996 г. для пшеничной непросеянной муки (CRM 121), сухого молока (CRM 421), овощной смеси (CRM 485) и свиной печени сублимационной сушки (CRM 487) в результате межлабораторных испытаний, организованных Европейской Комиссией в рамках "Программы стандартных измерений и испытаний". Статистические данные, полученные в результате межлабораторных испытаний, приведены в приложении С.
8.2 Повторяемость
Абсолютное расхождение между результатами двух независимых единичных испытаний, полученными одним методом на идентичном объекте испытаний в одной лаборатории одним оператором с использованием одного оборудования в течение короткого промежутка времени, не должно превышать предел повторяемости более чем в 5% случаев.
Значения предела повторяемости в расчете на гидрохлорид тиаминхлорида равны:
- для пшеничной непросеянной муки 0,452 мг/100 г,
0,043 мг/100 г;
- для сухого молока 0,645 мг/100 г,
0,071 мг/100 г;
- для овощной смеси 0,295 мг/100 г,
0,039 мг/100 г;
- для свиной печени 0,807 мг/100 г,
0,088 мг/100 г.
8.3 Воспроизводимость
Абсолютное расхождение между результатами двух единичных испытаний, полученными одним методом на идентичном объекте испытаний в разных лабораториях разными операторами с использованием разного оборудования не должно превышать предел воспроизводимости более чем в 5% случаев.
Значения предела воспроизводимости повторяемости в расчете на гидрохлорид тиаминхлорида равны:
- для пшеничной непросеянной муки 0,452 мг/100 г,
0,190 мг/100 г;
- для сухого молока 0,645 мг/100 г,
0,243 мг/100 г;
- для овощной смеси 0,295 мг/100 г,
0,178 мг/100 г;
- для свиной печени 0,807 мг/100 г,
0,623 мг/100 г.
9 Протокол результатов испытаний
Протокол результатов испытаний должен содержать как минимум следующие сведения:
a) всю информацию, необходимую для идентификации пробы;
b) указание использованного метода анализа со ссылкой на настоящий стандарт;
c) дату и способ отбора пробы (если известен);
d) фамилию и подпись лица, ответственного за проведение анализа;
e) дату поступления пробы в лабораторию;
f) результаты испытаний с указанием единиц измерения;
g) все нюансы, наблюдавшиеся при проведении анализа;
h) все операции, не оговоренные в методике или рассматриваемые как необязательные, которые могли повлиять на результат испытания.
Приложение A
(справочное)
Альтернативные условия хроматографического анализа
В таблице A.1 приведены условия хроматографического анализа, гарантированно обеспечивающие удовлетворительное качество хроматографического разделения и количественного анализа.
Таблица A.1 - Альтернативные условия хроматографического анализа*
________________
* Приведенные в таблице марки сорбентов - примеры изделий, пригодных для целей применения настоящего стандарта. Данная информация приведена для удобства применения настоящего стандарта, не является рекламной поддержкой МГС данных изделий и не исключает возможность использования других изделий с аналогичными свойствами
Марка и размер частиц сорбента колонки для ВЭЖХ | Размеры колонки, мм (длина | Состав подвижной фазы (объемное соотношение компонентов) | Скорость подачи подвижной фазы, см | Параметры флюоримет- | Способ дерива- |
Radial silica | 250x4,6 | Смесь этанола с фосфатным буферным раствором ( | 3,0 | 365/435 | 1 |
Supelco | 250x4,6 | Смесь метанола с фосфатным буферным раствором ( | 1,0 | 368/420 | 1 |
Lichro-spher | 250x4,6 | Смесь метанола с раствором гексансульфоната натрия ммоль/дм | 1,5 | 375/435 | 1 |
Eurospher | 250x4,6 | Смесь раствора однозамещенного фосфата натрия [ моль/дм | 1,0 | 375/435 | 1 |
Lichro-spher | 250x4,6 | Смесь метанола с ацетатным буферным раствором ( | 0,7 | 366/435 | 2 |
| 250x4,6 | Смесь метанола с ацетатным буферным раствором ( | 0,8 | 366/435 | 2 |
Spherisorb | 250x4,6 | Смесь метанола с фосфатным буферным раствором ( | 1,0 | 375/435 | 2 |
Supelco | 250x4,6 | Смесь метанола с фосфатным буферным раствором ( | 1,0 | 368/420 | 1 |
Lichrospher | 250x4,6 | Смесь раствора однозамещенного фосфата калия [ | 1,5 | 368/440 | 2 |
Hamilton | 150x4,6 | Смесь метанола с водой (40:60) с добавлением уксусной кислоты до | 1,0 | 366/435 | 2 |
Hamilton | 150x4,1 | Смесь метанола с водой (35:65) с добавлением раствора аммиака массовой долей | 1,0 | 366/435 | 2 |
Hypersil N
| 250x4,6 | Смесь дихлорметана с метанолом (95:5) | 1,0 | 365/440 | 2 |
| |||||
___________________
* Формула соответствует оригиналу. - .
Приложение B
(справочное)
Типичные хроматограммы
B.1 Пример хроматограммы градуировочного раствора тиамина с использованием предколоночной дериватизации с получением тиохрома приведен на рисунке B.1.
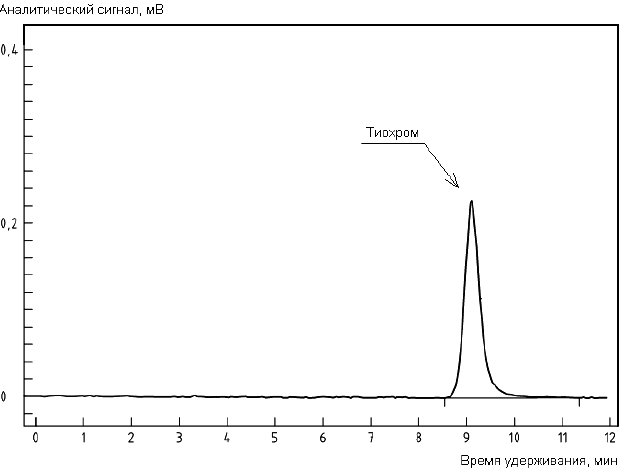
Рисунок B.1 - Пример хроматограммы градуировочного раствора тиамина с использованием предколоночной дериватизации с получением тиохрома
Условия хроматографического анализа:
Колонка длиной 250 мм, внутренним диаметром 4,0 мм, заполненная сорбентом Lichrospher RP Select B* диаметром частиц 5 мкм.
________________
* Lichrospher RP Select В - пример изделия, пригодного для целей применения настоящего стандарта. Данная информация приведена для удобства применения настоящего стандарта, не является рекламной поддержкой МГС данного изделия и не исключает возможность использования других изделий с аналогичными свойствами.
Состав подвижной фазы - смесь метанола (см. 4.2.1) с ацетатным буферным раствором (4,0) по 4.2.22 в объемном соотношении 40:60.
Скорость протока подвижной фазы - 0,7 см/мин.
Объем инжекции - 20 мм.
Условия детектирования - измерение флюоресценции при длине волны возбуждения 366 нм, длине волны эмиссии 435 нм.
B.2 Примеры хроматограмм экстрактов проб салата (a), вареного риса (b) и вареной свинины (с) с добавлением градуировочного раствора тиамина с применением послеколоночной дериватизации приведены на рисунке B.2.

a)
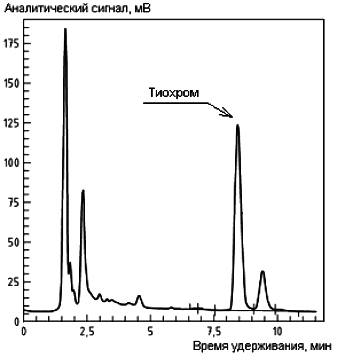
b)
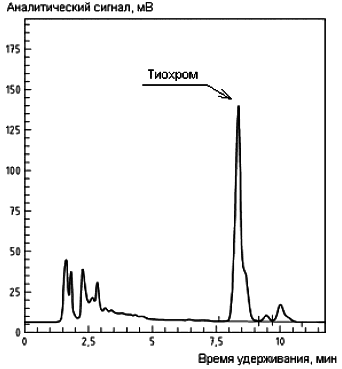
с)
Рисунок B.2 - Примеры хроматограмм экстрактов проб салата (a), вареного риса (b) и вареной свинины (с) с добавлением градуировочного раствора тиамина с применением послеколоночной дериватизации
Условия хроматографического анализа:
Колонка длиной 250 мм, внутренним диаметром 4,6 мм, заполненная сорбентом Purospher RP C18* диаметром частиц 5 мкм.
________________
* Purospher RP С18 - пример изделия, пригодного для целей применения настоящего стандарта. Данная информация приведена для удобства применения настоящего стандарта, не является рекламной поддержкой МГС данного изделия и не исключает возможность использования других изделий с аналогичными свойствами.
Состав подвижной фазы - смесь метанола (см. 4.2.1) с фосфатным буферным раствором (4,5,
![]() 10 ммоль/дм
10 ммоль/дм, массовая концентрация хлорида тетраэтиламмония (см. 4.2.20) 1 г/дм
, концентрация гептансульфоната натрия (см. 4.2.21) 5 ммоль/дм
) в объемном соотношении 35:70.
Скорость протока подвижной фазы - 1,5 см/мин.
Объем инжекции - 3 мм .
Реагент для послеколоночной дериватизации - щелочной раствор гексацианоферрата (III) калия (см. 4.2.14).
Скорость подачи дериватизирующего реагента - 0,3 см/мин.
Условия детектирования - измерение флюоресценции при длине волны возбуждения 365 нм, длине волны эмиссии 435 нм.
Приложение C
(справочное)
Данные по прецизионности методики
Данные, приведенные в таблице C.1, получены в результате межлабораторных испытаний, проведенных в соответствии с директивой Евросоюза по аттестации образцов сравнения (EU SMT Certification Study) [11]. Межлабораторные испытания были организованы Институтом исследований пищевых продуктов в Норвиче, Соединенное Королевство, по заданию Бюро эталонов Европейского сообщества. Данные, приведенные в таблицах C.2 и C.3 получены в результате межлабораторных испытаний, проведенных во Франции [5].
Таблица C.1 - Данные по прецизионности методики для непросеянной муки, сухого молока, овощной смеси и свиной печени
Проба | CRM 121 | CRM 421 Сухое молоко | CRM 485 Овощная смесь | CRM 487 Печень свиная лиофилизированная |
Год проведения испытаний | 1996 | 1996 | 1996 | 1996 |
Количество лабораторий-участников | 13 | 14 | 12 | 15 |
Количество проб | 2 | 2 | 2 | 2 |
Количество лабораторий, оставшихся после исключения выбросов | 13 | 14 | 12 | 15 |
Количество выбросов (лабораторий) | 0 | 0 | 0 | 0 |
Количество принятых результатов | 65 | 70 | 58 | 72 |
Среднее значение | 0,452 | 0,645 | 0,295 | 0,807 |
Стандартное отклонение, мг/100 г | 0,054 | 0,086 | 0,039 | 0,182 |
Стандартное отклонение повторяемости | 0,015 | 0,025 | 0,012 | 0,031 |
Относительное стандартное отклонение повторяемости, % | 3,2 | 3,8 | 4,2 | 3,9 |
Предел повторяемости | 0,043 | 0,071 | 0,039 | 0,088 |
Стандартное отклонение воспроизводимости | 0,053 | 0,085 | 0,063 | 0,182 |
Относительное стандартное отклонение воспроизводимости | 11,8 | 13,2 | 13,3 | 22,6 |
Предел воспроизводимости | 0,190 | 0,243 | 0,178 | 0,623 |
Таблица C.2 - Данные по прецизионности методики для: продукта для питания больных в стационарах, продукта для детского питания, сухого молока, продукта быстрого приготовления, содержащего фрукты и дрожжи
Проба | Продукт для питания больных в стационарах | Продукт для детского питания | Сухое молоко | Продукт быстрого приготов- | Дрожжи |
Год проведения испытаний | 1995 | 1995 | 1995 | 1995 | 1995 |
Количество лабораторий-участников | 10 | 10 | 10 | 10 | 10 |
Количество проб | 1 | 1 | 1 | 1 | 1 |
Количество лабораторий, оставшихся после исключения выбросов | 8 | 10 | 10 | 10 | 10 |
Количество выбросов (лабораторий) | 2 | 0 | 0 | 0 | 0 |
Количество принятых результатов | 16 | 20 | 20 | 20 | 20 |
Среднее значение | 0,11 | 0,2 | 0,56 | 1,04 | 1,31 |
Стандартное отклонение повторяемости | 0,01 | 0,02 | 0,04 | 0,07 | 0,12 |
Относительное стандартное отклонение повторяемости, % | 7 | 8 | 7 | 7 | 9 |
Предел повторяемости | 0,02 | 0,05 | 0,1 | 0,2 | 0,34 |
Стандартное отклонение воспроизводимости | 0,04 | 0,04 | 0,08 | 0,19 | 0,17 |
Относительное стандартное отклонение воспроизводимости | 32 | 21 | 16 | 19 | 13 |
Предел воспроизводимости | 0,1 | 0,12 | 0,25 | 0,55 | 0,48 |
Таблица C.3 - Данные по прецизионности методики для зерна, шоколадного порошка и смеси пищевых добавок
Проба | Зерно | Зерно | Шоколадный порошок | Смесь пищевых добавок |
Год проведения испытаний | 1995 | 1995 | 1995 | 1995 |
Количество лабораторий-участников | 10 | 10 | 10 | 10 |
Количество проб | 1 | 1 | 1 | 1 |
Количество лабораторий, оставшихся после исключения выбросов | 9 | 9 | 9 | 9 |
Количество выбросов (лабораторий) | 1 | 1 | 1 | 1 |
Количество принятых результатов | 18 | 18 | 18 | 18 |
Среднее значение | 1,42 | 2,95 | 1,55 | 486 |
Стандартное отклонение повторяемости | 0,06 | 0,18 | 0,13 | 39 |
Относительное стандартное отклонение повторяемости, % | 4 | 6 | 8 | 8 |
Предел повторяемости | 0,16 | 0,49 | 0,36 | 111 |
Стандартное отклонение воспроизводимости | 0,27 | 0,41 | 0,28 | 75 |
Относительное стандартное отклонение воспроизводимости | 19 | 14 | 19 | 15 |
Предел воспроизводимости | 0,75 | 1,16 | 0,8 | 212 |
Приложение ДА
(справочное)
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам
Таблица ДА.1
Обозначение и наименование международного стандарта | Степень соответствия | Обозначение и наименование межгосударственного стандарта |
ISO 3696:1987 Вода для лабораторного анализа. Технические требования и методы испытаний | - | * |
* Соответствующий межгосударственный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. | ||
Библиография
[1] |
|
[2] | Hasselmann, C., Franck, D., Grimm, P., Diop, P.A. und Soules, C.: High-performance liquid chromatographic analysis of thiamin and riboflavin in dietic foods. J. Micronutr. Anal. 5, 1989, 269. 279 |
[3] |
|
[4] |
|
[5] | Arella, F., |
[6] | Eitenmiller, R.R. und Landen, W.O.: Vitamin Analysis for the Health and Food Sciences. CRC Press, Boca Raton, London, New York, Washington, D.C, 1991, 271. 297 |
[7] | Dawson, R.M.C., Elliott, D.C., Elliot, W.H. und Jones, K.: Data for Biochemical Research. Oxfort Science Publication 3rd. ISBN 0 19 855299 8, 1998 |
[8] |
|
[9] | Takashi, U., Yukiko, Т., Kohei, M., Mari, T. und Kaname, K.: Simultaneous determination of 2(1-hydroxyethyl)thiamin and thiamin in foods by high performance liquid chromatography with post-column derivatisation. Vitamins (Japan), 64, 1990, 379. 385 |
[10] | Takashi, U., Yukiko, Т., Kohei, M., Masako, M. und Kaname, K.: Distribution and stability of 2(1-hydroxyethyl)thiamin and thiamin in foods. Vitamins (Japan), 65, 1991, 249. 256 |
[11] | Finglas, P.M., Scott, K.J., Witthoft, С.M., van den Berg, H. und de Froidmont-Gortz, I.: The certification of the mass fractions of vitamins in four reference materials: Wholemeal flour (CRM 121), milk powder (CRM 421), lyophilised mixed vegetables (CRM 485) and lyophilised pig.s liver (CRM 487). EUR-report 18320, Office for Official Publications of the European Communities, Luxembourg, 1999 |
____________________________________________________________________________
УДК 618.857.06.001.4:006.354 МКС 67.050 IDT
Ключевые слова: продукты пищевые, определение витамина В1, ферментативное дефосфорилирование, метод высокоэффективной жидкостной хроматографии, флюориметрическое детектирование, предколоночное окисление тиамина, послеколоночное окисление тиамина, тиохром
____________________________________________________________________________
Электронный текст документа
и сверен по:
, 2014

